Información de prescripción completa
Clorhidrato de lidocaína inyectable, USPSolución inyectable de clorhidrato de lidocaína sin conservantes
Inyección de clorhidrato de lidocaína USP, 1%.
Para infiltración y bloqueo nervioso
Rx solamente
DESCRIPCIÓN:
La inyección de clorhidrato de lidocaína, USP es una solución acuosa estéril, no pirogénica, que contiene un agente anestésico local y se administra parenteralmente por inyección. Ver INDICACIONES para usos específicos.
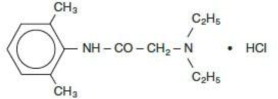
La solución contiene lidocaína HCl, que se designa químicamente como acetamida, 2-(dietilamino)-N-(2,6-dimetilfenil)-, monohidrocloruro y tiene un peso molecular de 270,8. Lidocaína HCl (C14H22N2O - HCl) tiene la siguiente fórmula estructural:
Las soluciones monodosis de inyección de clorhidrato de lidocaína USP no contienen metilparabenos.
La inyección de clorhidrato de lidocaína USP es una solución estéril, no pirogénica e isotónica que contiene cloruro de sodio. El pH de esta solución se ajusta a aproximadamente 6,5 (5,0 a 7,0) con hidróxido de sodio y/o ácido clorhídrico.
FARMACOLOGÍA CLÍNICA:
Mecanismo de acción:
El HCl de lidocaína estabiliza la membrana neuronal inhibiendo los flujos iónicos necesarios para el inicio y la conducción de los impulsos, con lo que se produce la acción anestésica local.
Hemodinámica:
Los niveles sanguíneos excesivos pueden provocar cambios en el gasto cardíaco, la resistencia periférica total y la presión arterial media. Con el bloqueo neural central, estos cambios pueden atribuirse al bloqueo de las fibras autonómicas, a un efecto depresor directo del agente anestésico local sobre diversos componentes del sistema cardiovascular, y/o a la acción estimulante de los receptores beta-adrenérgicos de la epinefrina cuando está presente. El efecto neto suele ser una modesta hipotensión cuando no se superan las dosis recomendadas.
Farmacocinética y metabolismo:
La información derivada de diversas formulaciones, concentraciones y usos revela que el HCl de lidocaína se absorbe completamente tras la administración parenteral, dependiendo su tasa de absorción, por ejemplo, de diversos factores como el lugar de administración y la presencia o ausencia de un agente vasoconstrictor. Excepto en el caso de la administración intravascular, los niveles sanguíneos más elevados se obtienen tras el bloqueo del nervio intercostal y los más bajos tras la administración subcutánea.
La unión plasmática del HCl de lidocaína depende de la concentración del fármaco, y la fracción unida disminuye con el aumento de la concentración. A concentraciones de 1 a 4 mcg de base libre por mL, del 60 al 80 por ciento de la lidocaína HCl está ligada a proteínas. La unión también depende de la concentración plasmática de la glicoproteína alfa-1-ácido.
El HCl de lidocaína atraviesa las barreras hematoencefálica y placentaria, presumiblemente por difusión pasiva.
El HCl de lidocaína se metaboliza rápidamente en el hígado, y los metabolitos y el fármaco inalterado se excretan por los riñones. La biotransformación incluye la N-alquilación oxidativa, la hidroxilación del anillo, la escisión del enlace amida y la conjugación. La N-alquilación, una de las principales vías de biotransformación, produce los metabolitos monoetilglicinexilidida y glicinexilidida. Las acciones farmacológicas/toxicológicas de estos metabolitos son similares, pero menos potentes, que las de la lidocaína HCl. Aproximadamente el 90% del HCl de lidocaína administrado se excreta en forma de diversos metabolitos, y menos del 10% se excreta sin cambios. El principal metabolito en orina es un conjugado de 4-hidroxi-2,6-dimetilanilina.
La semivida de eliminación del HCl de lidocaína tras una inyección intravenosa en bolo suele ser de 1,5 a 2 horas. Debido a la rápida velocidad a la que se metaboliza el HCl de lidocaína, cualquier condición que afecte la función hepática puede alterar la cinética del HCl de lidocaína. La vida media puede prolongarse dos veces o más en pacientes con disfunción hepática. La disfunción renal no afecta la cinética del HCl de lidocaína pero puede aumentar la acumulación de metabolitos.
Factores como la acidosis y el uso de estimulantes y depresores del SNC afectan a los niveles de lidocaína HCl en el SNC necesarios para producir efectos sistémicos manifiestos. Las manifestaciones adversas objetivas se hacen cada vez más evidentes con el aumento de los niveles plasmáticos venosos por encima de 6 mcg de base libre por mL. En el mono rhesus, los niveles en sangre arterial de 18 a 21 mcg/mL han demostrado ser el umbral para la actividad convulsiva.
INDICACIONES Y USO:
La inyección de clorhidrato de lidocaína, USP está indicada para la producción de anestesia local o regional mediante técnicas de infiltración como la inyección percutánea y la anestesia regional intravenosa mediante técnicas de bloqueo de nervios periféricos como el plexo braquial y el intercostal y mediante técnicas neurales centrales como los bloqueos epidurales lumbar y caudal, cuando se observan los procedimientos aceptados para estas técnicas descritos en los libros de texto estándar.
CONTRAINDICACIONES:
Lidocaína HCl está contraindicada en pacientes con antecedentes conocidos de hipersensibilidad a los anestésicos locales de tipo amida.
ADVERTENCIAS:
LA INYECCIÓN DE CLORHIDRATO DE LIDOCAÍNA, USP PARA INFILTRACIÓN Y BLOQUEO NERVIOSO SÓLO DEBE SER EMPLEADA POR CLÍNICOS BIEN VERSADOS EN EL DIAGNÓSTICO Y MANEJO DE LA TOXICIDAD RELACIONADA CON LA DOSIS Y OTRAS EMERGENCIAS AGUDAS QUE PUEDAN SURGIR DEL BLOQUEO A EMPLEAR Y SÓLO DESPUÉS DE ASEGURAR LA DISPONIBILIDAD INMEDIATA DE OXÍGENO, OTROS MEDICAMENTOS RESUSTIVOS, EQUIPO CARDIOPULMONAR Y EL PERSONAL NECESARIO PARA EL MANEJO ADECUADO DE LAS REACCIONES TÓXICAS Y EMERGENCIAS RELACIONADAS (ver también ADVERTENCIAS Y PRECAUCIONES). EL RETRASO EN EL MANEJO ADECUADO DE LA TOXICIDAD RELACIONADA CON LA DOSIS, LA HIPOVENTILACIÓN POR CUALQUIER CAUSA Y/O LA ALTERACIÓN DE LA SENSIBILIDAD PUEDEN CONDUCIR AL DESARROLLO DE ACIDOSIS, PARO CARDÍACO Y, POSIBLEMENTE, LA MUERTE.
Metahemoglobinemia
Se han notificado casos de metahemoglobinemia asociados al uso de anestésicos locales. Aunque todos los pacientes corren el riesgo de sufrir metahemoglobinemia, los pacientes con deficiencia de glucosa-6-fosfato deshidrogenasa, metahemoglobinemia congénita o idiopática, compromiso cardíaco o pulmonar, lactantes menores de 6 meses de edad y exposición simultánea a agentes oxidantes o sus metabolitos son más susceptibles de desarrollar manifestaciones clínicas de la afección. Si deben utilizarse anestésicos locales en estos pacientes, se recomienda una estrecha vigilancia para detectar síntomas y signos de metahemoglobinemia.
Los signos de metahemoglobinemia pueden aparecer inmediatamente o retrasarse algunas horas tras la exposición, y se caracterizan por una coloración cianótica de la piel y/o una coloración anormal de la sangre. Los niveles de metahemoglobina pueden seguir aumentando; por lo tanto, se requiere tratamiento inmediato para evitar efectos adversos más graves sobre el sistema nervioso central y cardiovascular, incluyendo convulsiones, coma, arritmias y muerte. Interrumpir Lidocaína HCl Inyectable, USP y otros agentes oxidantes. Dependiendo de la gravedad de los signos y síntomas, los pacientes pueden responder a cuidados de apoyo, es decir, oxigenoterapia, hidratación. Una presentación clínica más grave puede requerir tratamiento con azul de metileno, exanguinotransfusión u oxígeno hiperbárico.
Las infusiones intraarticulares de anestésicos locales tras procedimientos artroscópicos y otros procedimientos quirúrgicos es un uso no aprobado, y ha habido informes posteriores a la comercialización de condrólisis en pacientes que recibieron dichas infusiones. La mayoría de los casos notificados de condrólisis han afectado a la articulación del hombro; se han descrito casos de condrólisis glenohumeral en pacientes pediátricos y adultos tras infusiones intraarticulares de anestésicos locales con y sin epinefrina durante periodos de 48 a 72 horas. No se dispone de información suficiente para determinar si períodos de infusión más cortos no se asocian a estos hallazgos. El momento de aparición de los síntomas, como dolor articular, rigidez y pérdida de movimiento, puede ser variable, pero puede comenzar ya en el segundo mes tras la cirugía. En la actualidad, no existe ningún tratamiento eficaz para la condrolisis; los pacientes que la han sufrido han precisado procedimientos diagnósticos y terapéuticos adicionales y algunos han necesitado una artroplastia o una sustitución del hombro.
Para evitar la inyección intravascular, debe realizarse una aspiración antes de inyectar la solución anestésica local. La aguja debe reposicionarse hasta que la aspiración no provoque el retorno de la sangre. Obsérvese, no obstante, que la ausencia de sangre en la jeringa no garantiza que se haya evitado la inyección intravascular.
No deben utilizarse soluciones anestésicas locales que contengan conservantes antimicrobianos (p. ej., metilparabeno) para la anestesia epidural o espinal, ya que no se ha establecido la seguridad de estos agentes con respecto a la inyección intratecal, ya sea intencionada o accidental.
Las soluciones de Lidocaína HCl con epinefrina contienen metabisulfito sódico, un sulfito que puede causar reacciones de tipo alérgico, incluyendo síntomas anafilácticos y episodios asmáticos potencialmente mortales o menos graves en ciertas personas susceptibles. La prevalencia global de la sensibilidad a los sulfitos en la población general es desconocida y probablemente baja. La sensibilidad a los sulfitos se observa con más frecuencia en personas asmáticas que en no asmáticas.
Pueden producirse reacciones anafilácticas tras la administración de clorhidrato de lidocaína (ver REACCIONES ADVERSAS).
En caso de reacción grave, interrumpa el uso del medicamento.
PRECAUCIONES:
General
La seguridad y eficacia del HCl de lidocaína dependen de la dosis adecuada, la técnica correcta, las precauciones adecuadas y la preparación para emergencias. Deben consultarse los libros de texto estándar para conocer las técnicas y precauciones específicas de los distintos procedimientos anestésicos regionales.
El equipo de reanimación, el oxígeno y otros medicamentos de reanimación deben estar disponibles para su uso inmediato. (Ver ADVERTENCIAS y REACCIONES ADVERSAS). Debe utilizarse la dosis más baja que produzca una anestesia eficaz para evitar niveles plasmáticos elevados y efectos adversos graves. También deben realizarse aspiraciones con jeringa antes y durante cada inyección suplementaria cuando se utilicen técnicas de catéter permanente. Durante la administración de anestesia epidural, se recomienda administrar inicialmente una dosis de prueba y monitorizar al paciente para detectar toxicidad en el sistema nervioso central y toxicidad cardiovascular, así como signos de administración intratecal no intencionada, antes de proceder. Cuando las condiciones clínicas lo permitan, debe considerarse la posibilidad de emplear soluciones anestésicas locales que contengan epinefrina para la dosis de prueba, ya que los cambios circulatorios compatibles con la epinefrina también pueden servir como señal de advertencia de una inyección intravascular no intencionada. Una inyección intravascular sigue siendo posible incluso si las aspiraciones de sangre son negativas. Las dosis repetidas de lidocaína HCl pueden causar aumentos significativos en los niveles sanguíneos con cada dosis repetida debido a la lenta acumulación del fármaco o de sus metabolitos. La tolerancia a niveles sanguíneos elevados varía con el estado del paciente. Los pacientes debilitados, ancianos, enfermos agudos y niños deben recibir dosis reducidas acordes con su edad y estado físico. Lidocaína HCl también debe utilizarse con precaución en pacientes con shock grave o bloqueo cardíaco.
La anestesia epidural lumbar y caudal debe utilizarse con extrema precaución en personas con las siguientes afecciones: enfermedad neurológica existente, deformidades de la columna vertebral, septicemia e hipertensión grave.
Las soluciones anestésicas locales que contienen un vasoconstrictor deben utilizarse con precaución y en cantidades cuidadosamente circunscritas en zonas del cuerpo irrigadas por arterias terminales o que tengan un riego sanguíneo comprometido. Los pacientes con enfermedad vascular periférica y aquellos con enfermedad vascular hipertensiva pueden mostrar una respuesta vasoconstrictora exagerada. Pueden producirse lesiones isquémicas o necrosis. Los preparados que contienen un vasoconstrictor deben utilizarse con precaución en pacientes durante o después de la administración de agentes anestésicos generales potentes, ya que pueden producirse arritmias cardiacas en tales condiciones.
Después de cada inyección de anestésico local debe realizarse una monitorización cuidadosa y constante de los signos vitales cardiovasculares y respiratorios (adecuación de la ventilación) y del estado de conciencia del paciente. Debe tenerse en cuenta en esos momentos que la inquietud, la ansiedad, los acúfenos, los mareos, la visión borrosa, los temblores, la depresión o la somnolencia pueden ser signos precoces de toxicidad del sistema nervioso central.
Dado que los anestésicos locales de tipo amida son metabolizados por el hígado, la inyección de clorhidrato de lidocaína, USP debe utilizarse con precaución en pacientes con enfermedad hepática. Los pacientes con enfermedad hepática grave, debido a su incapacidad para metabolizar normalmente los anestésicos locales, tienen mayor riesgo de desarrollar concentraciones plasmáticas tóxicas. La inyección de clorhidrato de lidocaína, USP también debe utilizarse con precaución en pacientes con deterioro de la función cardiovascular, ya que pueden ser menos capaces de compensar los cambios funcionales asociados con la prolongación de la conducción A-V producida por estos fármacos.
Muchos fármacos utilizados durante la realización de la anestesia se consideran agentes desencadenantes potenciales de la hipertermia maligna familiar. Puesto que no se sabe si los anestésicos locales de tipo amida pueden desencadenar esta reacción y puesto que la necesidad de anestesia general suplementaria no puede predecirse de antemano, se sugiere disponer de un protocolo estándar para el tratamiento de la hipertermia maligna. Los primeros signos inexplicables de taquicardia, taquipnea, presión arterial lábil y acidosis metabólica pueden preceder a la elevación de la temperatura. El éxito depende del diagnóstico precoz, la rápida interrupción del agente o agentes desencadenantes sospechosos y la instauración de un tratamiento que incluya oxigenoterapia, las medidas de apoyo indicadas y dantroleno (consultar el prospecto de dantroleno sódico intravenoso antes de utilizarlo).
Una técnica de torniquete adecuada, tal como se describe en publicaciones y libros de texto estándar, es esencial en la realización de anestesia regional intravenosa. Para esta técnica no deben utilizarse soluciones que contengan epinefrina u otros vasoconstrictores.
Lidocaína HCl debe utilizarse con precaución en personas con sensibilidad conocida a los medicamentos. Los pacientes alérgicos a los derivados del ácido paraaminobenzoico (procaína, tetracaína, benzocaína, etc.) no han mostrado sensibilidad cruzada al HCl de lidocaína.
Uso en la zona de la cabeza y el cuello
Pequeñas dosis de anestésicos locales inyectados en la zona de cabeza y cuello, incluyendo bloqueos retrobulbares, dentales y del ganglio estrellado, pueden producir reacciones adversas similares a la toxicidad sistémica observada con inyecciones intravasculares no intencionadas de dosis mayores. Se han notificado confusión, convulsiones, depresión respiratoria y/o parada respiratoria, y estimulación o depresión cardiovascular. Estas reacciones pueden deberse a la inyección intraarterial del anestésico local con flujo retrógrado a la circulación cerebral. Los pacientes que reciben estos bloqueos deben tener la circulación y la respiración monitorizadas y ser observados constantemente. Debe disponerse inmediatamente de equipo de reanimación y personal para tratar las reacciones adversas. No deben excederse las recomendaciones posológicas (ver POSOLOGÍA Y ADMINISTRACIÓN).
Información para pacientes
Cuando proceda, los pacientes deben ser informados de antemano de que pueden experimentar una pérdida temporal de sensibilidad y actividad motora, normalmente en la mitad inferior del cuerpo, tras la administración adecuada de la anestesia epidural.
Interacciones medicamentosas clínicamente significativas
La administración de soluciones anestésicas locales que contienen epinefrina o norepinefrina a pacientes que reciben inhibidores de la monoaminooxidasa o antidepresivos tricíclicos puede producir hipertensión grave y prolongada.
Las fenotiazinas y butirofenonas pueden reducir o invertir el efecto presor de la epinefrina.
En general, debe evitarse el uso concomitante de estos agentes. En los casos en los que sea necesario un tratamiento simultáneo, es esencial una cuidadosa monitorización del paciente.
La administración concomitante de fármacos vasopresores (para el tratamiento de la hipotensión relacionada con bloqueos obstétricos) y fármacos oxitócicos de tipo cornezuelo de centeno puede causar hipertensión grave y persistente o accidentes cerebrovasculares.
Interacciones entre medicamentos y pruebas de laboratorio
La inyección intramuscular de HCl de lidocaína puede provocar un aumento de los niveles de creatina fosfoquinasa. Así pues, el uso de esta determinación enzimática, sin separación de isoenzimas, como prueba diagnóstica de la presencia de infarto agudo de miocardio puede verse comprometido por la inyección intramuscular de HCl de lidocaína.
Los pacientes a los que se administran anestésicos locales corren un mayor riesgo de desarrollar metahemoglobinemia cuando se exponen simultáneamente a los siguientes fármacos, que podrían incluir otros anestésicos locales:
Ejemplos de medicamentos asociados a la metahemoglobinemia:
| Nitratos/Nitritos | Óxido nítrico, nitroglicerina, nitroprusiato, óxido nitroso |
| Anestésicos locales | Articano, benzocaína, bupivacaína, lidocaína, mepivacaína, prilocaína, procaína, ropivacaína, tetracaína |
| Agentes antineoplásicos | Ciclofosfamida, flutamida, hidroxiurea, ifosfamida, rasburicasa |
| Antibióticos | Dapsona, nitrofurantoína, ácido para-aminosalicílico, sulfonamidas |
| Antimaláricos | Choloroquina, primaquina |
| Anticonvulsivos | Fenobarbital, fenitoína, valproato sódico |
| Otros medicamentos | Paracetamol, metoclopramida, quinina, sulfasalazina |
Carcinogénesis, mutagénesis, alteración de la fertilidad
No se han realizado estudios del HCl de lidocaína en animales para evaluar el potencial carcinogénico y mutagénico o el efecto sobre la fertilidad.
Embarazo
Efectos teratogénicos: Embarazo Categoría B.
Se han realizado estudios de reproducción en ratas a dosis de hasta 6,6 veces la dosis humana y no han revelado evidencias de daño al feto causado por el HCl de lidocaína. Sin embargo, no existen estudios adecuados y bien controlados en mujeres embarazadas. Los estudios de reproducción animal no siempre predicen la respuesta humana. Debe tenerse en cuenta este hecho antes de administrar lidocaína HCl a mujeres en edad fértil, especialmente al principio del embarazo, cuando tiene lugar la máxima organogénesis.
Parto y alumbramiento
Los anestésicos locales atraviesan rápidamente la placenta y cuando se utilizan para anestesia epidural, paracervical, pudenda o bloqueo caudal, pueden causar diversos grados de toxicidad materna, fetal y neonatal. (ver FARMACOLOGÍA CLÍNICA, Farmacocinética y Metabolismo). El potencial de toxicidad depende del procedimiento realizado, del tipo y cantidad de fármaco utilizado y de la técnica de administración del fármaco. Las reacciones adversas en la parturienta, el feto y el neonato implican alteraciones del sistema nervioso central, del tono vascular periférico y de la función cardíaca.
La anestesia regional ha provocado hipotensión materna. Los anestésicos locales producen vasodilatación al bloquear los nervios simpáticos. Elevar las piernas de la paciente y colocarla sobre su lado izquierdo ayudará a prevenir descensos de la tensión arterial.
La frecuencia cardiaca fetal también debe controlarse continuamente, y la monitorización fetal electrónica es muy aconsejable.
La anestesia epidural, espinal, paracervical o pudenda puede alterar las fuerzas del parto a través de cambios en la contractilidad uterina o los esfuerzos expulsivos maternos. En un estudio, la anestesia de bloqueo paracervical se asoció a una disminución de la duración media de la primera fase del parto y a la facilitación de la dilatación cervical. Sin embargo, también se ha observado que la anestesia raquídea y epidural prolonga la segunda fase del parto al eliminar el impulso reflejo de la parturienta de agacharse o al interferir con la función motora. El uso de anestesia obstétrica puede aumentar la necesidad de asistencia con fórceps.
El uso de algunos fármacos anestésicos locales durante el parto puede ir seguido de una disminución de la fuerza y el tono muscular durante el primer o segundo día de vida. Se desconoce el significado a largo plazo de estas observaciones. Puede producirse bradicardia fetal en el 20-30% de las pacientes que reciben anestesia de bloqueo nervioso paracervical con anestésicos locales de tipo amida y puede estar asociada a acidosis fetal. La frecuencia cardiaca fetal debe controlarse siempre durante la anestesia paracervical. El médico debe sopesar las posibles ventajas frente a los riesgos al considerar un bloqueo paracervical en prematuridad, toxemia del embarazo y sufrimiento fetal. En el bloqueo paracervical obstétrico es de suma importancia seguir cuidadosamente las dosis recomendadas. Si no se consigue una analgesia adecuada con las dosis recomendadas, debe sospecharse una inyección intravascular o intracraneal fetal. Se han notificado casos compatibles con inyección intracraneal fetal no intencionada de solución anestésica local tras un bloqueo paracervical o pudendo intencionado, o ambos. Los bebés así afectados presentan una depresión neonatal inexplicable al nacer, que se correlaciona con niveles séricos elevados de anestésico local, y a menudo manifiestan convulsiones en las seis horas siguientes. Para tratar esta complicación se han utilizado con éxito medidas de apoyo inmediatas combinadas con la excreción urinaria forzada del anestésico local.
Los informes de casos de convulsiones maternas y colapso cardiovascular tras el uso de algunos anestésicos locales para el bloqueo paracervical al inicio del embarazo (como anestesia para el aborto electivo) sugieren que la absorción sistémica en estas circunstancias puede ser rápida. No debe superarse la dosis máxima recomendada de cada fármaco. La inyección debe realizarse lentamente y con aspiración frecuente. Dejar un intervalo de 5 minutos entre inyecciones.
Madres lactantes
Se desconoce si este medicamento se excreta en la leche humana. Dado que muchos fármacos se excretan en la leche humana, debe tenerse precaución cuando se administre lidocaína HCl a una mujer lactante.
Uso pediátrico
Las dosis en niños deben reducirse, de acuerdo con la edad, peso corporal y condición física (ver POSOLOGÍA Y ADMINISTRACIÓN).
REACCIONES ADVERSAS
Sistémico
Las experiencias adversas tras la administración de lidocaína HCl son de naturaleza similar a las observadas con otros agentes anestésicos locales amídicos. Estas experiencias adversas están, en general, relacionadas con la dosis y pueden ser el resultado de niveles plasmáticos elevados causados por una dosis excesiva, absorción rápida o inyección intravascular inadvertida, o pueden ser el resultado de una hipersensibilidad, idiosincrasia o tolerancia disminuida por parte del paciente. Las experiencias adversas graves son generalmente de naturaleza sistémica. Los siguientes tipos son los que se notifican con mayor frecuencia:
Sistema nervioso central
Las manifestaciones del SNC son excitatorias y/o depresoras y pueden caracterizarse por aturdimiento, nerviosismo, aprensión, euforia, confusión, mareo, somnolencia, tinnitus, visión borrosa o doble, vómitos, sensaciones de calor, frío o entumecimiento, sacudidas, temblores, convulsiones, inconsciencia, depresión respiratoria y parada. Las manifestaciones excitatorias pueden ser muy breves o no producirse en absoluto, en cuyo caso la primera manifestación de toxicidad puede ser somnolencia que se funde en inconsciencia y parada respiratoria.
La somnolencia tras la administración de lidocaína HCl suele ser un signo precoz de un nivel sanguíneo elevado del fármaco y puede producirse como consecuencia de una rápida absorción.
Sistema cardiovascular
Las manifestaciones cardiovasculares suelen ser depresoras y se caracterizan por bradicardia, hipotensión y colapso cardiovascular, que puede conducir a una parada cardiaca.
Alérgico
Las reacciones alérgicas se caracterizan por lesiones cutáneas, urticaria, edema o reacciones anafilactoides. Las reacciones alérgicas pueden producirse como resultado de la sensibilidad a los agentes anestésicos locales o al metilparabeno utilizado como conservante en los viales de dosis múltiples. Pueden producirse reacciones alérgicas, incluidas reacciones anafilácticas, como resultado de la sensibilidad a la lidocaína, pero son infrecuentes. Si se producen reacciones alérgicas, deben tratarse por medios convencionales. La detección de sensibilidad mediante pruebas cutáneas es de dudoso valor.
No se han notificado casos de sensibilidad cruzada entre el clorhidrato de lidocaína y la procainamida ni entre el clorhidrato de lidocaína y la quinidina.
Neurológico
La incidencia de reacciones adversas asociadas al uso de anestésicos locales puede estar relacionada con la dosis total de anestésico local administrada y también depende del fármaco concreto utilizado, la vía de administración y el estado físico del paciente. En una revisión prospectiva de 10.440 pacientes que recibieron HCl de lidocaína para anestesia raquídea, se notificó que la incidencia de reacciones adversas fue de aproximadamente el 3% para cefaleas posicionales, hipotensión y dolor de espalda; el 2% para escalofríos; y menos del 1% para síntomas nerviosos periféricos, náuseas, insuficiencia respiratoria y visión doble. Muchas de estas observaciones pueden estar relacionadas con las técnicas de anestesia local, con o sin contribución del anestésico local.
En la práctica del bloqueo epidural caudal o lumbar, puede producirse una penetración ocasional no intencionada del catéter en el espacio subaracnoideo. Los efectos adversos subsiguientes pueden depender parcialmente de la cantidad de fármaco administrado por vía subdural. Estos pueden incluir bloqueo espinal de magnitud variable (incluido el bloqueo espinal total), hipotensión secundaria al bloqueo espinal, pérdida del control de la vejiga y los intestinos, y pérdida de la sensibilidad perineal y de la función sexual. En raras ocasiones, cuando se ha intentado el bloqueo epidural caudal o lumbar, se ha notificado un déficit motor, sensorial y/o autonómico (control de esfínteres) persistente de algunos segmentos espinales inferiores con recuperación lenta (varios meses) o incompleta. También se han observado dolores de espalda y de cabeza tras el uso de estos procedimientos anestésicos.
Se han notificado casos de lesión permanente de los músculos extraoculares que han requerido reparación quirúrgica tras la administración retrobulbar.
Hematológico
Metahemoglobinemia.
SOBREDOSIS
Las emergencias agudas por anestésicos locales están generalmente relacionadas con niveles plasmáticos elevados encontrados durante el uso terapéutico de anestésicos locales o con la inyección subaracnoidea no intencionada de solución anestésica local (ver REACCIONES ADVERSAS, ADVERTENCIAS y PRECAUCIONES).
Manejo de las urgencias anestésicas locales
La primera consideración es la prevención, que se consigue mejor mediante una monitorización cuidadosa y constante de las constantes vitales cardiovasculares y respiratorias y del estado de consciencia del paciente después de cada inyección de anestesia local. A la primera señal de cambio, debe administrarse oxígeno.
El primer paso en el manejo de las convulsiones, así como de la subventilación o apnea debidas a la inyección subaracnoidea involuntaria de solución medicamentosa, consiste en la atención inmediata al mantenimiento de una vía aérea permeable y la ventilación asistida o controlada con oxígeno y un sistema de administración capaz de permitir la presión positiva inmediata en la vía aérea mediante mascarilla. Inmediatamente después de la instauración de estas medidas ventilatorias, debe evaluarse la adecuación de la circulación, teniendo en cuenta que los fármacos utilizados para tratar las convulsiones a veces deprimen la circulación cuando se administran por vía intravenosa. Si las convulsiones persisten a pesar de una asistencia respiratoria adecuada, y si el estado de la circulación lo permite, pueden administrarse por vía intravenosa pequeños incrementos de un barbitúrico de acción ultracorta (como el tiopental o el tiamilal) o una benzodiacepina (como el diazepam). El clínico debe estar familiarizado, antes del uso de anestésicos locales, con estos fármacos anticonvulsivantes. El tratamiento de apoyo de la depresión circulatoria puede requerir la administración de fluidos intravenosos y, cuando proceda, un vasopresor según indique la situación clínica (por ejemplo, efedrina).
Si no se tratan inmediatamente, tanto las convulsiones como la depresión cardiovascular pueden producir hipoxia, acidosis, bradicardia, arritmias y parada cardiaca. La subventilación o la apnea debidas a una inyección subaracnoidea involuntaria de solución anestésica local pueden producir estos mismos signos y también provocar una parada cardiaca si no se instaura un soporte ventilatorio. Si se produce una parada cardiaca, deben aplicarse las medidas estándar de reanimación cardiopulmonar.
La intubación endotraqueal, empleando fármacos y técnicas familiares para el clínico, puede estar indicada, tras la administración inicial de oxígeno por mascarilla, si se encuentran dificultades para mantener una vía aérea permeable o si está indicado un soporte ventilatorio prolongado (asistido o controlado).
La diálisis tiene un valor insignificante en el tratamiento de la sobredosificación aguda con HCl de lidocaína. La DL50 oral de HCl de lidocaína en ratas hembras sin ayuno es de 459 (346 a 773) mg/kg (como la sal) y de 214 (159 a 324) mg/kg (como la sal) en ratas hembras en ayunas.
POSOLOGÍA Y ADMINISTRACIÓN
La Tabla 1 (Dosis Recomendadas) resume los volúmenes y concentraciones recomendados de Clorhidrato de Lidocaína Inyectable, USP para varios tipos de procedimientos anestésicos. Las dosis sugeridas en esta tabla son para adultos sanos normales y se refieren al uso de soluciones con epinefrina. Cuando se requieran volúmenes mayores, sólo deben utilizarse soluciones que contengan epinefrina, excepto en aquellos casos en los que los fármacos vasopresores puedan estar contraindicados.
Se han notificado acontecimientos adversos de condrólisis en pacientes que recibieron infusiones intraarticulares de anestésicos locales después de procedimientos artroscópicos y otros procedimientos quirúrgicos. La inyección de clorhidrato de lidocaína USP no está aprobada para este uso (ver ADVERTENCIAS y POSOLOGÍA Y ADMINISTRACIÓN).
Estas dosis recomendadas sólo sirven como guía de la cantidad de anestésico necesaria para la mayoría de los procedimientos rutinarios. Los volúmenes y concentraciones reales que deben utilizarse dependen de una serie de factores, como el tipo y el alcance de la intervención quirúrgica, la profundidad de la anestesia y el grado de relajación muscular necesario, la duración de la anestesia requerida y el estado físico del paciente. En todos los casos debe administrarse la concentración más baja y la dosis más pequeña que produzca el resultado deseado. Las dosis deben reducirse en niños y en pacientes ancianos y debilitados, así como en pacientes con enfermedades cardíacas y/o hepáticas.
El inicio de la anestesia, la duración de la anestesia y el grado de relajación muscular son proporcionales al volumen y la concentración (es decir, la dosis total) del anestésico local utilizado. Por lo tanto, un aumento en el volumen y la concentración de la inyección de clorhidrato de lidocaína, USP disminuirá el inicio de la anestesia, prolongará la duración de la anestesia, proporcionará un mayor grado de relajación muscular y aumentará la propagación segmentaria de la anestesia. Sin embargo, el aumento del volumen y la concentración de la inyección de clorhidrato de lidocaína, USP puede dar lugar a una caída más profunda de la presión arterial cuando se utiliza en la anestesia epidural. Aunque la incidencia de efectos secundarios con lidocaína HCl es bastante baja, debe tenerse precaución al emplear grandes volúmenes y concentraciones, ya que la incidencia de efectos secundarios es directamente proporcional a la dosis total de agente anestésico local inyectado.
Para la anestesia regional intravenosa, sólo debe utilizarse el vial monodosis de 50 ml que contiene Lidocaína HCl 0,5% Inyección.
Anestesia epidural
Para la anestesia epidural, sólo se recomiendan las siguientes formas farmacéuticas de Lidocaína HCl Inyectable, USP:
| 1% sin epinefrina | Soluciones monodosis de 30 ml |
| 1% con epinefrina 1:200.000 | Soluciones monodosis de 30 ml |
| 1,5% sin epinefrina | Ampolla de plástico de 10 ml |
| 1,5% sin epinefrina | Ampolla de plástico de 20 ml |
| 1,5% con epinefrina 1:200.000 | Ampollas de 30 ml, soluciones monodosis de 30 ml |
| 2% sin epinefrina | Ampolla de plástico de 10 ml |
| 2% con epinefrina 1:200.000 | Ampollas de 20 ml, soluciones monodosis de 20 ml |
Aunque estas soluciones están destinadas específicamente a la anestesia epidural, también pueden utilizarse para la infiltración y el bloqueo nervioso periférico, siempre que se empleen como unidades monodosis. Estas soluciones no contienen ningún agente bacteriostático.
En la anestesia epidural, la dosis varía en función del número de dermatomas a anestesiar (generalmente de 2 a 3mL de la concentración indicada por dermatoma).
Bloqueo Epidural Caudal y Lumbar
Como precaución contra la experiencia adversa observada a veces tras la penetración involuntaria en el espacio subaracnoideo, debe administrarse una dosis de prueba de 3 a 4,5 ml de lidocaína HCl al 1,0% al menos 5 minutos antes de inyectar el volumen total necesario para un bloqueo epidural lumbar o caudal. La dosis de prueba debe repetirse si el paciente se mueve de forma que pueda haber desplazado el catéter. La epinefrina, si está contenida en la dosis de prueba (se han sugerido de 10 a 15 mcg), puede servir como advertencia de inyección intravascular involuntaria. Si se inyecta en un vaso sanguíneo, es probable que esta cantidad de epinefrina produzca una "respuesta epinefrínica" transitoria en 45 segundos, consistente en un aumento de la frecuencia cardiaca y de la presión arterial sistólica, palidez circunoral, palpitaciones y nerviosismo en el paciente no sedado. El paciente sedado puede mostrar sólo un aumento del pulso de 20 o más latidos por minuto durante 15 o más segundos. Los pacientes que reciben betabloqueantes pueden no manifestar cambios en la frecuencia cardiaca, pero la monitorización de la tensión arterial puede detectar un aumento evanescente de la tensión arterial sistólica. Se debe dejar un tiempo adecuado para el inicio de la anestesia tras la administración de cada dosis de prueba. Debe evitarse la inyección rápida de un gran volumen de inyección de clorhidrato de lidocaína, USP a través del catéter y, cuando sea factible, deben administrarse dosis fraccionadas.
En caso de inyección conocida de un gran volumen de solución anestésica local en el espacio subaracnoideo, tras una reanimación adecuada y si el catéter está colocado, considere la posibilidad de intentar la recuperación del fármaco drenando una cantidad moderada de líquido cefalorraquídeo (como 10 mL) a través del catéter epidural.
DOSIS MÁXIMAS RECOMENDADAS:
Adultos
Para adultos sanos normales, la dosis máxima individual recomendada de lidocaína HCl con epinefrina no debe exceder de 7 mg/kg (3,5 mg/lb) de peso corporal, y en general se recomienda que la dosis máxima total no exceda de 500 mg. Cuando se utiliza sin epinefrina, la dosis individual máxima no debe exceder de 4,5 mg/kg (2 mg/lb) de peso corporal, y en general se recomienda que la dosis total máxima no exceda de 300 mg. Para la anestesia caudal continua, la dosis máxima recomendada no debe administrarse a intervalos inferiores a 90 minutos. Cuando se utiliza anestesia epidural lumbar o caudal continua para procedimientos no obstétricos, puede administrarse más fármaco si es necesario para producir una anestesia adecuada.
La dosis máxima recomendada por período de 90 minutos de clorhidrato de lidocaína para el bloqueo paracervical en pacientes obstétricas y no obstétricas es de 200 mg en total. Normalmente se administra la mitad de la dosis total en cada lado. Inyectar lentamente, cinco minutos entre cada lado (ver también la discusión del bloqueo paracervical en PRECAUCIONES).
Para la anestesia regional intravenosa, la dosis administrada no debe superar los 4 mg/kg en adultos.
Niños
Es difícil recomendar una dosis máxima de cualquier fármaco para los niños, ya que ésta varía en función de la edad y el peso. Para los niños mayores de 3 años que tienen una masa corporal magra normal y un desarrollo corporal normal, la dosis máxima viene determinada por la edad y el peso del niño. Por ejemplo, en un niño de 5 años que pese 15 kg, la dosis de lidocaína HCl no debe exceder de 75 a 100 mg (1,5 a 2 mg/lb). Para la inducción de la anestesia regional intravenosa en niños se recomienda el uso de soluciones aún más diluidas (es decir, de 0,25 a 0,5%) y dosis totales que no superen los 3 mg/kg (1,4 mg/lb).
A fin de evitar la toxicidad sistémica, debe utilizarse siempre la concentración efectiva más baja y la dosis efectiva más baja. En algunos casos será necesario diluir las concentraciones disponibles con cloruro sódico inyectable al 0,9% para obtener la concentración final requerida.
NOTA: Los productos farmacéuticos parenterales deben inspeccionarse visualmente en busca de partículas y decoloración antes de su administración siempre que la solución y el envase lo permitan. La inyección no debe utilizarse si su color es rosáceo o más oscuro que ligeramente amarillo o si contiene un precipitado.
Tabla 1: Dosis recomendadas para la inyección de clorhidrato de lidocaína (sin epinefrina)
| Infiltración | |||
| Percutánea | 0,5 o 1 | 1 a 60 | 5 a 300 |
| Intravenosa regional | 0.5 | 10 a 60 | De 50 a 300 |
| Bloqueos de nervios periféricos, p. ej, | |||
| Braquial | 1.5 | 15 a 20 | 225 a 300 |
| Dental | 2 | 1 a 5 | De 20 a 100 |
| Intercostal | 1 | 3 | 30 |
| Paravertebral | 1 | De 3 a 5 años | 30 a 50 |
| Pudendal (cada lado) | 1 | 10 | 100 |
| Paracervical | |||
| Analgesia obstétrica | |||
| (cada lado) | 1 | 10 | 100 |
| Bloqueos del nervio simpático, p. ej, | |||
| Cervicales (ganglio estrellado) | 1 | 5 | 50 |
| Lumbares | 1 | De 5 a 10 | 50 a 100 |
| Bloqueos neuronales centrales | |||
| Epidural* | |||
| Torácica | 1 | De 20 a 30 | De 200 a 300 |
| Lumbares | |||
| Analgesia | 1 | De 25 a 30 | De 250 a 300 |
| Anestesia | 1.5 | 15 a 20 | 225 a 300 |
| 2 | 10 a 15 | De 200 a 300 | |
| Caudal | |||
| Analgesia obstétrica | 1 | De 20 a 30 | De 200 a 300 |
| Anestesia quirúrgica | 1.5 | 15 a 20 | 225 a 300 |
*Dosis determinada por el número de dermatomas a anestesiar (2-3 ml/dermatoma).
LAS CONCENTRACIONES Y VOLÚMENES SUGERIDOS MÁS ARRIBA SON SÓLO ORIENTATIVOS. PUEDEN UTILIZARSE OTROS VOLÚMENES Y CONCENTRACIONES SIEMPRE QUE NO SE SUPERE LA DOSIS MÁXIMA TOTAL RECOMENDADA.
ESTERILIZACIÓN, ALMACENAMIENTO Y PROCEDIMIENTOS TÉCNICOS:
Los agentes desinfectantes que contienen metales pesados, que provocan la liberación de los iones respectivos (mercurio, zinc, cobre, etc.) no deben utilizarse para la desinfección de la piel o las mucosas, ya que se han relacionado con incidentes de hinchazón y edema. Si se desea desinfectar químicamente los viales multidosis, se recomienda utilizar alcohol isopropílico (91%) o alcohol etílico (70%). Muchas marcas comerciales de alcohol para fricciones, así como soluciones de alcohol etílico que no son de grado USP, contienen desnaturalizantes que son perjudiciales para el caucho y, por lo tanto, no deben utilizarse.
CÓMO SE SUMINISTRA
La inyección de clorhidrato de lidocaína, USP se suministra de la siguiente manera:
| 65282-1605-1 | Ampolla monodosis (caja de 25) | 1% (10 mg/mL) | 5 ml | 50 |
Todas las soluciones deben almacenarse a una temperatura de 20° a 25°C (68° a 77°F) [ver USP Temperatura ambiente controlada].
Proteger de la luz.
Fabricado para:
Spectra Medical Devices, Inc.
Wilmington, MA 01887
Llame gratis al (866) 938 - 8649
Fabricado por:
Huons Co., Ltd.,
Seúl, Corea del Sur
Código del producto: 1605-1
Revisado: 03/2019
Etiqueta SMD AW-0075, rev. 002
Publicado: 03/2019

