Informações completas sobre a prescrição
Cloridrato de Lidocaína, Injeção, USPPolivalente de cloridrato de lidocaína, solução injetável sem conservantes
Injeção de Cloridrato de Lidocaína USP, 1%
Para Infiltração e Bloqueio Nervoso
Apenas Rx
DESCRIÇÃO:
A Injeção de Cloridrato de Lidocaína, USP é uma solução aquosa estéril, não pirogénica, que contém um agente anestésico local e é administrada por injeção parentérica. Ver INDICAÇÕES para utilizações específicas.
A solução contém lidocaína HCl, que é quimicamente designada como acetamida, 2-(dietilamino)-N-(2,6-dimetilfenil)-, monocloridrato e tem o peso molecular de 270,8. A lidocaína HCl (C14H22N2O - HCl) tem a seguinte fórmula estrutural:
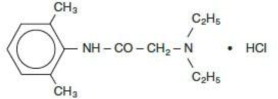
As soluções de dose única de Cloridrato de Lidocaína Injetável, USP não contêm metilparabeno.
A Injeção de Cloridrato de Lidocaína, USP é uma solução isotónica estéril, não pirogénica, que contém cloreto de sódio. O pH desta solução é ajustado para aproximadamente 6,5 (5,0 a 7,0) com hidróxido de sódio e/ou ácido clorídrico.
FARMACOLOGIA CLÍNICA:
Mecanismo de ação:
O Cloridrato de Lidocaína estabiliza a membrana neuronal inibindo os fluxos iónicos necessários para a iniciação e condução dos impulsos, exercendo assim uma ação anestésica local.
Hemodinâmica:
Níveis sanguíneos excessivos podem causar alterações no débito cardíaco, na resistência periférica total e na pressão arterial média. Com o bloqueio neural central, estas alterações podem ser atribuídas ao bloqueio das fibras autonómicas, a um efeito depressor direto do agente anestésico local em vários componentes do sistema cardiovascular e/ou à ação estimuladora dos receptores beta-adrenérgicos da epinefrina, quando presente. O efeito líquido é normalmente uma hipotensão modesta quando as doses recomendadas não são excedidas.
Farmacocinética e Metabolismo:
A informação derivada de diversas formulações, concentrações e utilizações revela que a lidocaína HCl é completamente absorvida após administração parentérica, dependendo a sua taxa de absorção, por exemplo, de vários factores como o local de administração e a presença ou ausência de um agente vasoconstritor. Exceptuando a administração intravascular, os níveis sanguíneos mais elevados são obtidos após o bloqueio do nervo intercostal e os mais baixos após a administração subcutânea.
A ligação plasmática da lidocaína HCl depende da concentração do fármaco, e a fração ligada diminui com o aumento da concentração. Em concentrações de 1 a 4 mcg de base livre por ml, 60 a 80 por cento do cloridrato de lidocaína está ligado à proteína. A ligação também depende da concentração plasmática da glicoproteína alfa-1-ácido.
O cloridrato de lidocaína atravessa as barreiras hemato-encefálicas e placentárias, presumivelmente por difusão passiva.
O Cloridrato de Lidocaína é metabolizado rapidamente pelo fígado e os metabolitos e o fármaco inalterado são excretados pelos rins. A biotransformação inclui a N-desalquilação oxidativa, a hidroxilação do anel, a clivagem da ligação amida e a conjugação. A N-desalquilação, uma das principais vias de biotransformação, produz os metabolitos monoetilglicinaxilidida e glicinaxilidida. As acções farmacológicas/toxicológicas destes metabolitos são semelhantes, mas menos potentes, do que as da lidocaína HCl. Cerca de 90% do cloridrato de lidocaína administrado é excretado sob a forma de vários metabolitos e menos de 10% é excretado inalterado. O principal metabolito na urina é um conjugado de 4-hidroxi-2,6-dimetilanilina.
A semi-vida de eliminação do cloridrato de lidocaína após uma injeção intravenosa em bolus é tipicamente de 1,5 a 2 horas. Devido à rápida taxa de metabolização da lidocaína HCl, qualquer condição que afecte a função hepática pode alterar a cinética da lidocaína HCl. A meia-vida pode ser prolongada duas vezes ou mais em pacientes com disfunção hepática. A disfunção renal não afecta a cinética da lidocaína HCl, mas pode aumentar a acumulação de metabolitos.
Factores como a acidose e a utilização de estimulantes e depressores do SNC afectam os níveis de lidocaína HCl no SNC necessários para produzir efeitos sistémicos evidentes. As manifestações adversas objectivas tornam-se cada vez mais evidentes com o aumento dos níveis plasmáticos venosos acima de 6 mcg de base livre por ml. No macaco rhesus, os níveis sanguíneos arteriais de 18 a 21 mcg/mL demonstraram ser o limiar para a atividade convulsiva.
INDICAÇÕES E UTILIZAÇÃO:
A Injeção de Cloridrato de Lidocaína, USP é indicada para a produção de anestesia local ou regional por técnicas de infiltração, como a injeção percutânea e a anestesia regional intravenosa, por técnicas de bloqueio de nervos periféricos, como o plexo braquial e intercostal, e por técnicas neurais centrais, como os bloqueios epidurais lombares e caudais, quando são observados os procedimentos aceites para estas técnicas, tal como descritos nos manuais escolares normais.
CONTRA-INDICAÇÕES:
A lidocaína HCl está contra-indicada em doentes com antecedentes conhecidos de hipersensibilidade a anestésicos locais do tipo amida.
ADVERTÊNCIAS:
A INJECÇÃO DE CLORIDRATO DE LIDOCAÍNA, USP PARA INFILTRAÇÕES E BLOQUEIOS NERVOSOS SÓ DEVE SER UTILIZADA POR CLÍNICOS QUE ESTEJAM BEM FAMILIARIZADOS COM O DIAGNÓSTICO E A GESTÃO DA TOXICIDADE RELACIONADA COM A DOSE E OUTRAS EMERGÊNCIAS AGUDAS QUE POSSAM SURGIR DO BLOQUEIO A SER UTILIZADO E SÓ DEPOIS DE ASSEGURAR A DISPONIBILIDADE IMEDIATA DE OXIGÉNIO, OUTRAS DROGAS RESUSCITATIVAS, EQUIPAMENTO CARDIOPULMONAR E O PESSOAL NECESSÁRIO PARA O GERENCIAMENTO CORRETO DAS REAÇÕES TÓXICAS E EMERGÊNCIAS RELACIONADAS (ver também ADVERTÊNCIAS e PRECAUÇÕES). O ATRASO NA GESTÃO ADEQUADA DA TOXICIDADE RELACIONADA COM A DOSE, A SUBVENTILAÇÃO POR QUALQUER CAUSA E/OU A ALTERAÇÃO DA SENSIBILIDADE PODEM LEVAR AO DESENVOLVIMENTO DE ACIDOSE, PARAGEM CARDÍACA E, POSSIVELMENTE, MORTE.
Metemoglobinemia
Foram notificados casos de metemoglobinemia associados à utilização de anestésicos locais. Embora todos os doentes estejam em risco de metemoglobinemia, os doentes com deficiência de glicose-6-fosfato desidrogenase, metemoglobinemia congénita ou idiopática, compromisso cardíaco ou pulmonar, crianças com menos de 6 meses de idade e exposição simultânea a agentes oxidantes ou seus metabolitos são mais susceptíveis de desenvolver manifestações clínicas da doença. Se os anestésicos locais tiverem de ser utilizados nestes doentes, recomenda-se uma monitorização atenta dos sintomas e sinais de metemoglobinemia.
Os sinais de metemoglobinémia podem ocorrer imediatamente ou demorar algumas horas após a exposição e são caracterizados por uma descoloração cianótica da pele e/ou coloração anormal do sangue. Os níveis de metemoglobina podem continuar a aumentar; por conseguinte, é necessário tratamento imediato para evitar efeitos adversos mais graves no sistema nervoso central e cardiovascular, incluindo convulsões, coma, arritmias e morte. Interromper a administração de Lidocaína HCl Injection, USP e de outros agentes oxidantes. Dependendo da gravidade dos sinais e sintomas, os doentes podem responder a cuidados de suporte, ou seja, oxigenoterapia e hidratação. Uma apresentação clínica mais grave pode exigir tratamento com azul de metileno, transfusão de sangue ou oxigénio hiperbárico.
As infusões intra-articulares de anestésicos locais após procedimentos artroscópicos e outros procedimentos cirúrgicos são uma utilização não aprovada, tendo havido relatos pós-comercialização de condrólise em doentes que receberam tais infusões. A maioria dos casos notificados de condrólise envolveu a articulação do ombro; foram descritos casos de condrólise gleno-umeral em doentes pediátricos e adultos após infusões intra-articulares de anestésicos locais com e sem epinefrina durante períodos de 48 a 72 horas. Não existe informação suficiente para determinar se períodos de infusão mais curtos não estão associados a estes achados. O tempo de início dos sintomas, como dor nas articulações, rigidez e perda de movimento, pode ser variável, mas pode começar logo no segundo mês após a cirurgia. Atualmente, não existe um tratamento eficaz para a condrólise; os doentes que sofreram condrólise necessitaram de procedimentos diagnósticos e terapêuticos adicionais e alguns necessitaram de artroplastia ou substituição do ombro.
Para evitar a injeção intravascular, a aspiração deve ser realizada antes da injeção da solução anestésica local. A agulha deve ser reposicionada até que a aspiração não provoque qualquer retorno de sangue. Note-se, no entanto, que a ausência de sangue na seringa não garante que a injeção intravascular tenha sido evitada.
As soluções anestésicas locais que contêm conservantes antimicrobianos (por exemplo, metilparabeno) não devem ser utilizadas para anestesia epidural ou raquianestesia, uma vez que a segurança destes agentes não foi estabelecida no que respeita à injeção intratecal, quer intencional quer acidental.
As soluções de cloridrato de lidocaína com epinefrina contêm metabissulfito de sódio, um sulfito que pode causar reacções do tipo alérgico, incluindo sintomas anafilácticos e episódios asmáticos com risco de vida ou menos graves em determinadas pessoas susceptíveis. A prevalência global da sensibilidade ao sulfito na população em geral é desconhecida e provavelmente baixa. A sensibilidade aos sulfitos é observada mais frequentemente em pessoas asmáticas do que em pessoas não asmáticas.
Podem ocorrer reacções anafilácticas após a administração de cloridrato de lidocaína (ver REACÇÕES ADVERSAS).
Em caso de reação grave, interromper a utilização do medicamento.
PRECAUÇÕES:
Geral
A segurança e eficácia do cloridrato de lidocaína dependem da dosagem adequada, da técnica correcta, das precauções adequadas e da prontidão para emergências. Devem ser consultados livros de texto padrão para técnicas e precauções específicas para vários procedimentos anestésicos regionais.
O equipamento de reanimação, o oxigénio e outros medicamentos de reanimação devem estar disponíveis para utilização imediata. (Ver ADVERTÊNCIAS e REACÇÕES ADVERSAS). Deve ser utilizada a dose mais baixa que resulte numa anestesia eficaz para evitar níveis plasmáticos elevados e efeitos adversos graves. A aspiração da seringa também deve ser efectuada antes e durante cada injeção suplementar quando se utilizam técnicas de cateteres de demora. Durante a administração de anestesia epidural, recomenda-se que seja administrada inicialmente uma dose de teste e que o doente seja monitorizado quanto a toxicidade do sistema nervoso central e toxicidade cardiovascular, bem como quanto a sinais de administração intratecal não intencional, antes de prosseguir. Quando as condições clínicas o permitirem, deve ser considerada a utilização de soluções anestésicas locais que contenham epinefrina para a dose de teste, uma vez que as alterações circulatórias compatíveis com a epinefrina podem também servir como sinal de aviso de uma injeção intravascular não intencional. Uma injeção intravascular é ainda possível mesmo que a aspiração de sangue seja negativa. Doses repetidas de cloridrato de lidocaína podem causar aumentos significativos dos níveis sanguíneos em cada dose repetida devido à acumulação lenta do fármaco ou dos seus metabolitos. A tolerância a níveis sanguíneos elevados varia consoante o estado do doente. Os doentes debilitados, os idosos, os doentes com doenças agudas e as crianças devem receber doses reduzidas de acordo com a sua idade e condição física. O cloridrato de lidocaína deve também ser utilizado com precaução em doentes com choque grave ou bloqueio cardíaco.
A anestesia epidural lombar e caudal deve ser utilizada com extrema precaução em pessoas com as seguintes condições: doença neurológica existente, deformações da coluna vertebral, septicemia e hipertensão grave.
As soluções anestésicas locais que contenham um vasoconstritor devem ser utilizadas com precaução e em quantidades cuidadosamente circunscritas em áreas do corpo irrigadas por artérias terminais ou que tenham uma irrigação sanguínea comprometida. Os doentes com doença vascular periférica e os doentes com doença vascular hipertensiva podem apresentar uma resposta vasoconstritora exagerada. Pode ocorrer lesão isquémica ou necrose. As preparações que contêm um vasoconstritor devem ser utilizadas com precaução em doentes durante ou após a administração de agentes anestésicos gerais potentes, uma vez que podem ocorrer arritmias cardíacas nestas condições.
Deve ser efectuada uma monitorização cuidadosa e constante dos sinais vitais cardiovasculares e respiratórios (adequação da ventilação) e do estado de consciência do doente após cada injeção de anestésico local. Nessas alturas, deve ter-se em conta que a inquietação, ansiedade, zumbidos, tonturas, visão turva, tremores, depressão ou sonolência podem ser sinais de alerta precoce de toxicidade para o sistema nervoso central.
Uma vez que os anestésicos locais do tipo amida são metabolizados pelo fígado, o Cloridrato de Lidocaína Injetável, USP deve ser utilizado com precaução em doentes com doença hepática. Os doentes com doença hepática grave, devido à sua incapacidade de metabolizar normalmente os anestésicos locais, correm um maior risco de desenvolver concentrações plasmáticas tóxicas. O Cloridrato de Lidocaína, Injeção USP também deve ser utilizado com precaução em doentes com função cardiovascular comprometida, uma vez que podem ser menos capazes de compensar as alterações funcionais associadas ao prolongamento da condução A-V produzido por estes fármacos.
Muitos fármacos utilizados durante a realização da anestesia são considerados potenciais agentes desencadeantes de hipertermia maligna familiar. Uma vez que não se sabe se os anestésicos locais do tipo amida podem desencadear esta reação e uma vez que a necessidade de anestesia geral suplementar não pode ser prevista antecipadamente, sugere-se que esteja disponível um protocolo padrão para a gestão da hipertermia maligna. Sinais iniciais inexplicáveis de taquicardia, taquipneia, pressão arterial instável e acidose metabólica podem preceder a elevação da temperatura. O êxito do tratamento depende do diagnóstico precoce, da interrupção imediata do(s) agente(s) desencadeante(s) suspeito(s) e da instituição de tratamento, incluindo oxigenoterapia, medidas de apoio indicadas e dantrolene (consultar o folheto informativo do dantrolene sódico intravenoso antes de o utilizar).
A técnica correcta de torniquete, tal como descrita em publicações e livros de texto padrão, é essencial para a realização de anestesia regional intravenosa. Não devem ser utilizadas soluções que contenham epinefrina ou outros vasoconstritores para esta técnica.
O cloridrato de lidocaína deve ser utilizado com precaução em pessoas com sensibilidades medicamentosas conhecidas. Os doentes alérgicos aos derivados do ácido para-aminobenzóico (procaína, tetracaína, benzocaína, etc.) não demonstraram sensibilidade cruzada ao cloridrato de lidocaína.
Utilização na zona da cabeça e do pescoço
Pequenas doses de anestésicos locais injectadas na zona da cabeça e do pescoço, incluindo bloqueios retrobulbar, dentário e do gânglio estrelado, podem produzir reacções adversas semelhantes à toxicidade sistémica observada com injecções intravasculares não intencionais de doses maiores. Foram notificados casos de confusão, convulsões, depressão respiratória e/ou paragem respiratória e estimulação ou depressão cardiovascular. Estas reacções podem ser devidas à injeção intra-arterial do anestésico local com fluxo retrógrado para a circulação cerebral. Os doentes que recebem estes bloqueios devem ter a sua circulação e respiração monitorizadas e ser constantemente observados. Deve estar imediatamente disponível equipamento de reanimação e pessoal para o tratamento de reacções adversas. As recomendações de dosagem não devem ser excedidas (ver DOSAGEM E ADMINISTRAÇÃO).
Informações para os doentes
Quando apropriado, os doentes devem ser informados antecipadamente de que podem sofrer uma perda temporária de sensibilidade e de atividade motora, normalmente na metade inferior do corpo, após a administração adequada da anestesia epidural.
Interacções medicamentosas clinicamente significativas
A administração de soluções anestésicas locais contendo epinefrina ou norepinefrina a doentes a receber inibidores da monoamina oxidase ou antidepressivos tricíclicos pode produzir hipertensão grave e prolongada.
As fenotiazinas e as butirofenonas podem reduzir ou inverter o efeito pressor da epinefrina.
A utilização simultânea destes agentes deve ser geralmente evitada. Nas situações em que é necessária uma terapêutica simultânea, é essencial uma monitorização cuidadosa do doente.
A administração simultânea de fármacos vasopressores (para o tratamento da hipotensão relacionada com bloqueios obstétricos) e de fármacos ocitócicos do tipo ergot pode causar hipertensão grave e persistente ou acidentes cerebrovasculares.
Interacções entre medicamentos e testes laboratoriais
A injeção intramuscular de lidocaína HCl pode resultar num aumento dos níveis de creatina fosfoquinase. Assim, a utilização desta determinação enzimática, sem separação isoenzimática, como teste de diagnóstico da presença de enfarte agudo do miocárdio pode ser comprometida pela injeção intramuscular de lidocaína HCl.
Os doentes a quem são administrados anestésicos locais correm um risco acrescido de desenvolver metemoglobinemia quando expostos simultaneamente aos seguintes fármacos, que podem incluir outros anestésicos locais:
Exemplos de medicamentos associados à metemoglobinemia:
| Nitratos/Nitritos | Óxido nítrico, nitroglicerina, nitroprussiato, óxido nitroso |
| Anestésicos locais | Articano, benzocaína, bupivacaína, lidocaína, mepivacaína, prilocaína, procaína, ropivacaína, tetracaína |
| Agentes antineoplásicos | Ciclofosfamida, flutamida, hidroxiureia, ifosfamida, rasburicase |
| Antibióticos | Dapsona, nitrofurantoína, ácido para-aminosalicílico, sulfonamidas |
| Antimaláricos | Coloroquina, primaquina |
| Anticonvulsivantes | Fenobarbital, fenitoína, valproato de sódio |
| Outros medicamentos | Acetaminofeno, metoclopramida, quinino, sulfassalazina |
Carcinogénese, Mutagénese, Prejuízo da Fertilidade
Não foram realizados estudos sobre o cloridrato de lidocaína em animais para avaliar o potencial carcinogénico e mutagénico ou o efeito sobre a fertilidade.
Gravidez
Efeitos teratogénicos: Gravidez Categoria B.
Foram efectuados estudos de reprodução em ratos com doses até 6,6 vezes superiores à dose humana e não revelaram qualquer evidência de danos para o feto causados pelo cloridrato de lidocaína. Não existem, no entanto, estudos adequados e bem controlados em mulheres grávidas. Os estudos de reprodução animal nem sempre são preditivos da resposta humana. Este facto deve ser tido em consideração antes da administração de cloridrato de lidocaína a mulheres com potencial para engravidar, especialmente durante o início da gravidez, quando ocorre a organogénese máxima.
Trabalho de parto e parto
Os anestésicos locais atravessam rapidamente a placenta e, quando utilizados para anestesia epidural, paracervical, pudenda ou caudal, podem causar vários graus de toxicidade materna, fetal e neonatal. (ver FARMACOLOGIA CLÍNICA, Farmacocinética e Metabolismo). O potencial de toxicidade depende do procedimento efectuado, do tipo e quantidade de fármaco utilizado e da técnica de administração do fármaco. As reacções adversas na parturiente, no feto e no recém-nascido envolvem alterações do sistema nervoso central, do tónus vascular periférico e da função cardíaca.
A hipotensão materna tem resultado da anestesia regional. Os anestésicos locais produzem vasodilatação ao bloquear os nervos simpáticos. A elevação das pernas da doente e o seu posicionamento sobre o lado esquerdo ajudam a evitar a diminuição da tensão arterial.
A frequência cardíaca do feto também deve ser monitorizada continuamente, sendo altamente aconselhável a monitorização fetal eletrónica.
A anestesia epidural, espinhal, paracervical ou pudenda pode alterar as forças do parto por meio de mudanças na contratilidade uterina ou nos esforços expulsivos maternos. Em um estudo, a anestesia por bloqueio paracervical foi associada a uma diminuição na duração média do primeiro estágio do trabalho de parto e à facilitação da dilatação cervical. No entanto, também foi relatado que a raquianestesia e a anestesia epidural prolongam o segundo estágio do trabalho de parto, removendo o impulso reflexo da parturiente de se abaixar ou interferindo na função motora. O uso de anestesia obstétrica pode aumentar a necessidade de assistência com fórceps.
A utilização de alguns fármacos anestésicos locais durante o trabalho de parto e o parto pode ser acompanhada por uma diminuição da força e do tónus muscular no primeiro ou segundo dia de vida. O significado a longo prazo destas observações é desconhecido. A bradicardia fetal pode ocorrer em 20 a 30% das pacientes que recebem anestesia de bloqueio do nervo paracervical com anestésicos locais do tipo amida e pode estar associada a acidose fetal. A frequência cardíaca fetal deve ser sempre monitorizada durante a anestesia paracervical. O médico deve pesar as possíveis vantagens em relação aos riscos ao considerar um bloqueio paracervical na prematuridade, toxemia da gravidez e sofrimento fetal. A adesão cuidadosa à dosagem recomendada é de extrema importância no bloqueio paracervical obstétrico. A não obtenção de analgesia adequada com as doses recomendadas deve levantar a suspeita de injeção intravascular ou intracraniana fetal. Foram notificados casos compatíveis com a injeção intracraniana fetal não intencional de solução anestésica local após um bloqueio paracervical ou pudendo, ou ambos. Os bebés assim afectados apresentam uma depressão neonatal inexplicável à nascença, que se correlaciona com níveis séricos elevados de anestésico local, e manifestam frequentemente convulsões no prazo de seis horas. O uso imediato de medidas de apoio, combinado com a excreção urinária forçada do anestésico local, tem sido usado com sucesso para controlar essa complicação.
Relatos de casos de convulsões maternas e colapso cardiovascular após a utilização de alguns anestésicos locais para bloqueio paracervical no início da gravidez (como anestesia para aborto eletivo) sugerem que a absorção sistémica nestas circunstâncias pode ser rápida. A dose máxima recomendada de cada medicamento não deve ser excedida. A injeção deve ser feita lentamente e com aspiração frequente. Permitir um intervalo de 5 minutos entre as injecções.
Mães que amamentam
Não se sabe se este medicamento é excretado no leite humano. Dado que muitos fármacos são excretados no leite humano, deve ter-se cuidado quando o cloridrato de lidocaína é administrado a uma mulher a amamentar.
Uso pediátrico
As doses em crianças devem ser reduzidas, de acordo com a idade, peso corporal e condição física (ver DOSAGEM E ADMINISTRAÇÃO).
REACÇÕES ADVERSAS
Sistémico
As experiências adversas após a administração de cloridrato de lidocaína são de natureza semelhante às observadas com outros agentes anestésicos locais amídicos. Estas reacções adversas estão, em geral, relacionadas com a dose e podem resultar de níveis plasmáticos elevados provocados por uma dose excessiva, absorção rápida ou injeção intravascular inadvertida, ou podem resultar de uma hipersensibilidade, idiossincrasia ou tolerância diminuída por parte do doente. As experiências adversas graves são geralmente de natureza sistémica. Os tipos seguintes são os mais frequentemente notificados:
Sistema Nervoso Central
As manifestações no SNC são excitatórias e/ou depressivas e podem ser caracterizadas por tonturas, nervosismo, apreensão, euforia, confusão, vertigens, sonolência, zumbidos, visão turva ou dupla, vómitos, sensações de calor, frio ou dormência, contracções, tremores, convulsões, inconsciência, depressão e paragem respiratória. As manifestações excitatórias podem ser muito breves ou não ocorrer de todo, caso em que a primeira manifestação de toxicidade pode ser a sonolência que se transforma em inconsciência e paragem respiratória.
A sonolência após a administração de cloridrato de lidocaína é normalmente um sinal precoce de um nível sanguíneo elevado do fármaco e pode ocorrer como consequência de uma absorção rápida.
Sistema Cardiovascular
As manifestações cardiovasculares são geralmente depressivas e caracterizam-se por bradicardia, hipotensão e colapso cardiovascular, que pode levar à paragem cardíaca.
Alérgico
As reacções alérgicas são caracterizadas por lesões cutâneas, urticária, edema ou reacções anafilactóides. As reacções alérgicas podem ocorrer em resultado da sensibilidade aos agentes anestésicos locais ou ao metilparabeno utilizado como conservante nos frascos para injetáveis de doses múltiplas. As reacções alérgicas, incluindo reacções anafilácticas, podem ocorrer em resultado da sensibilidade à lidocaína, mas são pouco frequentes. Se ocorrerem reacções alérgicas, estas devem ser tratadas pelos meios convencionais. A deteção da sensibilidade através de testes cutâneos é de valor duvidoso.
Não foram registados casos de sensibilidade cruzada entre o cloridrato de lidocaína e a procainamida ou entre o cloridrato de lidocaína e a quinidina.
Neurológico
A incidência de reacções adversas associadas à utilização de anestésicos locais pode estar relacionada com a dose total de anestésico local administrada e depende também do medicamento específico utilizado, da via de administração e do estado físico do doente. Numa análise prospetiva de 10 440 doentes que receberam cloridrato de lidocaína para raquianestesia, a incidência de reacções adversas foi de cerca de 3% cada para cefaleias posicionais, hipotensão e lombalgia; 2% para tremores; e menos de 1% cada para sintomas nervosos periféricos, náuseas, insuficiência respiratória e visão dupla. Muitas destas observações podem estar relacionadas com as técnicas de anestesia local, com ou sem uma contribuição do anestésico local.
Na prática do bloqueio epidural caudal ou lombar, pode ocorrer ocasionalmente a penetração não intencional do espaço subaracnoide pelo cateter. Os efeitos adversos subsequentes podem depender parcialmente da quantidade de fármaco administrada por via subdural. Estes podem incluir bloqueio da coluna vertebral de magnitude variável (incluindo bloqueio total da coluna vertebral), hipotensão secundária ao bloqueio da coluna vertebral, perda do controlo da bexiga e dos intestinos e perda da sensação perineal e da função sexual. Em raros casos de tentativa de anestesia epidural caudal ou lombar, foram notificados défices persistentes a nível motor, sensorial e/ou autonómico (controlo dos esfíncteres) de alguns segmentos inferiores da coluna vertebral, com recuperação lenta (vários meses) ou incompleta. Também foram registadas dores nas costas e dores de cabeça após a utilização destes procedimentos anestésicos.
Foram registados casos de lesões permanentes dos músculos extra-oculares que exigiram reparação cirúrgica após a administração retrobulbar.
Hematológico
Metemoglobinemia.
SOBREDOSAGEM
As emergências agudas provocadas pelos anestésicos locais estão geralmente relacionadas com níveis plasmáticos elevados encontrados durante a utilização terapêutica dos anestésicos locais ou com a injeção subaracnóidea não intencional de solução anestésica local (ver REACÇÕES ADVERSAS, ADVERTÊNCIAS e PRECAUÇÕES).
Gestão de emergências de anestesia local
A primeira consideração é a prevenção, que é melhor conseguida através da monitorização cuidadosa e constante dos sinais vitais cardiovasculares e respiratórios e do estado de consciência do doente após cada injeção de anestésico local. Ao primeiro sinal de alteração, deve ser administrado oxigénio.
O primeiro passo no tratamento das convulsões, bem como da subventilação ou apneia devido a uma injeção subaracnóidea não intencional de solução medicamentosa, consiste na atenção imediata à manutenção de uma via aérea desobstruída e na ventilação assistida ou controlada com oxigénio e um sistema de distribuição capaz de permitir uma pressão positiva imediata nas vias aéreas através de máscara. Imediatamente após a instituição destas medidas ventilatórias, deve ser avaliada a adequação da circulação, tendo em conta que os medicamentos utilizados no tratamento das convulsões por vezes deprimem a circulação quando administrados por via intravenosa. Se as convulsões persistirem apesar do suporte respiratório adequado, e se o estado da circulação o permitir, podem ser administrados por via intravenosa pequenos incrementos de um barbitúrico de ação ultracurta (como o tiopental ou o tiamilal) ou de uma benzodiazepina (como o diazepam). Antes da utilização de anestésicos locais, o médico deve estar familiarizado com estes fármacos anticonvulsivos. O tratamento de suporte da depressão circulatória pode exigir a administração de fluidos intravenosos e, quando apropriado, um vasopressor, conforme indicado pela situação clínica (por exemplo, efedrina).
Se não forem tratadas imediatamente, tanto as convulsões como a depressão cardiovascular podem resultar em hipoxia, acidose, bradicardia, arritmias e paragem cardíaca. A subventilação ou a apneia devidas a uma injeção subaracnóidea não intencional de solução anestésica local podem produzir estes mesmos sinais e também levar a paragem cardíaca se não for instituído suporte ventilatório. Se ocorrer uma paragem cardíaca, devem ser instituídas medidas normais de reanimação cardiopulmonar.
A intubação endotraqueal, utilizando fármacos e técnicas familiares ao clínico, pode ser indicada, após a administração inicial de oxigénio por máscara, se houver dificuldade em manter uma via aérea desobstruída ou se for indicado um suporte ventilatório prolongado (assistido ou controlado).
A diálise é de valor negligenciável no tratamento da sobredosagem aguda com cloridrato de lidocaína. A DL50 oral do cloridrato de lidocaína em ratos fêmeas não jejuados é de 459 (346 a 773) mg/kg (como sal) e de 214 (159 a 324) mg/kg (como sal) em ratos fêmeas jejuados.
DOSAGEM E ADMINISTRAÇÃO
O Quadro 1 (Dosagens recomendadas) resume os volumes e concentrações recomendados de Cloridrato de Lidocaína Injetável, USP para vários tipos de procedimentos anestésicos. As dosagens sugeridas nesta tabela são para adultos saudáveis normais e referem-se ao uso de soluções com epinefrina. Quando são necessários volumes maiores, devem ser utilizadas apenas soluções que contenham epinefrina, exceto nos casos em que os fármacos vasopressores possam estar contra-indicados.
Foram notificados acontecimentos adversos de condrólise em doentes que receberam infusões intra-articulares de anestésicos locais após procedimentos artroscópicos e outros procedimentos cirúrgicos. A Injeção de Cloridrato de Lidocaína, USP não está aprovada para esta utilização (ver ADVERTÊNCIAS e DOSAGEM E ADMINISTRAÇÃO).
Estas doses recomendadas servem apenas como um guia para a quantidade de anestésico necessária para a maioria dos procedimentos de rotina. Os volumes e concentrações reais a utilizar dependem de uma série de factores, tais como o tipo e a extensão do procedimento cirúrgico, a profundidade da anestesia e o grau de relaxamento muscular necessário, a duração da anestesia necessária e a condição física do doente. Em todos os casos, deve ser administrada a menor concentração e a menor dose que produzam o resultado desejado. As doses devem ser reduzidas no caso de crianças, idosos, doentes debilitados e doentes com doença cardíaca e/ou hepática.
O início da anestesia, a duração da anestesia e o grau de relaxamento muscular são proporcionais ao volume e à concentração (ou seja, à dose total) do anestésico local utilizado. Assim, um aumento do volume e da concentração de Cloridrato de Lidocaína Injetável, USP diminuirá o início da anestesia, prolongará a duração da anestesia, proporcionará um maior grau de relaxamento muscular e aumentará a propagação segmentar da anestesia. No entanto, o aumento do volume e da concentração de Cloridrato de Lidocaína Injetável, USP pode resultar numa queda mais profunda da pressão arterial quando utilizado em anestesia epidural. Embora a incidência de efeitos secundários com o cloridrato de lidocaína seja bastante baixa, deve ter-se cuidado quando se utilizam grandes volumes e concentrações, uma vez que a incidência de efeitos secundários é diretamente proporcional à dose total de agente anestésico local injetado.
Para anestesia regional intravenosa, apenas deve ser utilizado o frasco para injectáveis de dose única de 50 ml contendo Cloridrato de Lidocaína 0,5% Injetável.
Anestesia epidural
Para anestesia epidural, apenas são recomendadas as seguintes formas de dosagem de Lidocaína HCl Injetável, USP:
| 1% sem epinefrina | Soluções de dose única de 30 ml |
| 1% com epinefrina 1:200.000 | Soluções de dose única de 30 ml |
| 1,5% sem epinefrina | Ampola de plástico de 10 ml |
| 1,5% sem epinefrina | Ampola de plástico de 20 ml |
| 1,5% com epinefrina 1:200.000 | Ampolas de 30mL, soluções de dose única de 30mL |
| 2% sem epinefrina | Ampola de plástico de 10 ml |
| 2% com epinefrina 1:200.000 | Ampolas de 20mL, soluções de dose única de 20mL |
Embora estas soluções se destinem especificamente à anestesia epidural, também podem ser utilizadas para infiltração e bloqueio de nervos periféricos, desde que sejam empregues como unidades de dose única. Estas soluções não contêm qualquer agente bacteriostático.
Na anestesia epidural, a dosagem varia com o número de dermátomos a anestesiar (geralmente 2 a 3mL da concentração indicada por dermátomo).
Bloqueio epidural caudal e lombar
Como precaução contra a experiência adversa por vezes observada após a penetração não intencional do espaço subaracnoide, deve ser administrada uma dose de teste, como 3 a 4,5 ml de cloridrato de lidocaína a 1,0%, pelo menos 5 minutos antes de injetar o volume total necessário para um bloqueio epidural lombar ou caudal. A dose de teste deve ser repetida se o doente for movido de uma forma que possa ter deslocado o cateter. A epinefrina, se contida na dose de teste (foram sugeridos 10 a 15 mcg), pode servir de aviso de injeção intravascular não intencional. Se for injectada num vaso sanguíneo, esta quantidade de epinefrina é suscetível de produzir uma "resposta de epinefrina" transitória no espaço de 45 segundos, que consiste num aumento da frequência cardíaca e da pressão arterial sistólica, palidez circunferencial, palpitações e nervosismo no doente não sedado. O doente sedado pode apresentar apenas um aumento da frequência cardíaca de 20 ou mais batimentos por minuto durante 15 ou mais segundos. Os doentes que tomam beta-bloqueadores podem não manifestar alterações da frequência cardíaca, mas a monitorização da pressão arterial pode detetar uma subida evanescente da pressão arterial sistólica. Deve ser dado um tempo adequado para o início da anestesia após a administração de cada dose de teste. A injeção rápida de um grande volume de Cloridrato de Lidocaína Injetável, USP através do cateter deve ser evitada e, quando possível, devem ser administradas doses fraccionadas.
No caso de uma injeção conhecida de um grande volume de solução anestésica local no espaço subaracnoide, após uma reanimação adequada e se o cateter estiver colocado, considerar a possibilidade de tentar recuperar o fármaco através da drenagem de uma quantidade moderada de líquido cefalorraquidiano (por exemplo, 10 ml) através do cateter epidural.
DOSES MÁXIMAS RECOMENDADAS:
Adultos
Para adultos saudáveis normais, a dose individual máxima recomendada de cloridrato de lidocaína com epinefrina não deve exceder 7 mg/kg (3,5 mg/lb) de peso corporal e, em geral, recomenda-se que a dose total máxima não exceda 500 mg. Quando utilizado sem epinefrina, a dose individual máxima não deve exceder 4,5 mg/kg (2 mg/lb) de peso corporal e, em geral, recomenda-se que a dose total máxima não exceda 300 mg. Para anestesia caudal contínua, a dose máxima recomendada não deve ser administrada em intervalos inferiores a 90 minutos. Quando a anestesia epidural lombar ou caudal contínua é utilizada para procedimentos não obstétricos, pode ser administrado mais medicamento, se necessário, para produzir uma anestesia adequada.
A dose máxima recomendada por período de 90 minutos de cloridrato de lidocaína para bloqueio paracervical em doentes obstétricas e não obstétricas é de 200 mg no total. Geralmente, metade da dose total é administrada em cada lado. Injetar lentamente, cinco minutos entre os lados (ver também a discussão sobre o bloqueio paracervical nas PRECAUÇÕES).
Para anestesia regional intravenosa, a dose administrada não deve exceder 4 mg/kg em adultos.
Crianças
É difícil recomendar uma dose máxima de qualquer medicamento para crianças, uma vez que esta varia em função da idade e do peso. Para crianças com mais de 3 anos de idade que têm uma massa corporal magra normal e um desenvolvimento corporal normal, a dose máxima é determinada pela idade e peso da criança. Por exemplo, numa criança de 5 anos que pese 50 lbs, a dose de cloridrato de lidocaína não deve exceder 75 a 100 mg (1,5 a 2 mg/lb). Recomenda-se a utilização de soluções ainda mais diluídas (ou seja, 0,25 a 0,5%) e doses totais que não excedam 3 mg/kg (1,4 mg/lb) para a indução de anestesia regional intravenosa em crianças.
A fim de evitar a toxicidade sistémica, devem ser sempre utilizadas a concentração eficaz mais baixa e a dose eficaz mais baixa. Em alguns casos, será necessário diluir as concentrações disponíveis com uma injeção de cloreto de sódio a 0,9% para obter a concentração final necessária.
NOTA: Os medicamentos parentéricos devem ser inspeccionados visualmente quanto à presença de partículas e descoloração antes da administração, sempre que a solução e o recipiente o permitam. A Injeção não deve ser utilizada se a sua cor for rosada ou mais escura do que ligeiramente amarela ou se contiver um precipitado.
Tabela 1: Doses recomendadas para a injeção de cloridrato de lidocaína (sem epinefrina)
| Infiltração | |||
| Percutânea | 0,5 ou 1 | 1 a 60 | 5 a 300 |
| Regional intravenosa | 0.5 | 10 a 60 | 50 a 300 |
| Bloqueios de nervos periféricos, por exemplo, | |||
| Braquial | 1.5 | 15 a 20 | 225 a 300 |
| Dentária | 2 | 1 a 5 | 20 a 100 |
| Intercostal | 1 | 3 | 30 |
| Paravertebral | 1 | 3 a 5 | 30 a 50 |
| Pudendal (cada lado) | 1 | 10 | 100 |
| Paracervical | |||
| Analgesia obstétrica | |||
| (de cada lado) | 1 | 10 | 100 |
| Bloqueios do nervo simpático, por exemplo, | |||
| Cervical (gânglio estrelado) | 1 | 5 | 50 |
| Lombar | 1 | 5 a 10 | 50 a 100 |
| Bloqueios neurais centrais | |||
| Epidural* | |||
| Torácica | 1 | 20 a 30 | 200 a 300 |
| Lombar | |||
| Analgesia | 1 | 25 a 30 | 250 a 300 |
| Anestesia | 1.5 | 15 a 20 | 225 a 300 |
| 2 | 10 a 15 | 200 a 300 | |
| Caudal | |||
| Analgesia obstétrica | 1 | 20 a 30 | 200 a 300 |
| Anestesia cirúrgica | 1.5 | 15 a 20 | 225 a 300 |
*Dose determinada pelo número de dermátomos a anestesiar (2-3 ml/dermátomo).
AS CONCENTRAÇÕES E VOLUMES SUGERIDOS ACIMA SERVEM APENAS COMO ORIENTAÇÃO. PODEM SER UTILIZADOS OUTROS VOLUMES E CONCENTRAÇÕES DESDE QUE A DOSE MÁXIMA TOTAL RECOMENDADA NÃO SEJA EXCEDIDA.
ESTERILIZAÇÃO, ARMAZENAMENTO E PROCEDIMENTOS TÉCNICOS:
Os agentes desinfectantes que contêm metais pesados, que provocam a libertação dos respectivos iões (mercúrio, zinco, cobre, etc.), não devem ser utilizados para a desinfeção da pele ou das mucosas, uma vez que têm sido associados a incidentes de inchaço e edema. Quando se pretende uma desinfeção química dos frascos multidose, recomenda-se a utilização de álcool isopropílico (91%) ou de álcool etílico (70%). Muitas marcas de álcool para fricção disponíveis no mercado, bem como soluções de álcool etílico que não são de grau USP, contêm desnaturantes que são prejudiciais para a borracha, pelo que não devem ser utilizadas.
COMO FORNECIDO
A Injeção de Cloridrato de Lidocaína, USP é fornecida como se segue:
| 65282-1605-1 | Ampola de dose única (caixa de 25) | 1% (10 mg/mL) | 5 ml | 50 |
Todas as soluções devem ser armazenadas a uma temperatura entre 20° e 25°C (68° e 77°F) [ver USP Controlled Room Temperature].
Proteger da luz.
Fabricado para:
Spectra Medical Devices, Inc.
Wilmington, MA 01887
Número de telefone gratuito (866) 938 - 8649
Fabricado por:
Huons Co., Ltd,
Seul, Coreia do Sul
Código do produto: 1605-1
Revisão: 03/2019
Etiqueta SMD AW-0075, rev. 002
Lançado: 03/2019

